具有预后不良基因特征的年轻乳腺癌患者与更差DRFI和OS显著相关。
年轻乳腺癌患者的复发率和死亡风险明显高于年长患者,但其原因尚不明确。一项研究针对SOFT临床试验中HR+/HER2-早期乳腺癌绝经前患者的肿瘤进行了基因组测序,以确定绝经前年轻女性患者肿瘤中富集的基因组的驱动因素[1]。研究结果提示,
研究方法
随机、III期临床试验SOFT(NCT00066690)纳入了3066例HR+早期乳腺癌绝经前女性患者,随机分配接受他莫昔芬、他莫昔芬联合OFS或依西美坦联合OFS辅助内分泌治疗5年。本研究针对SOFT研究中HR+/HER2-患者的肿瘤样本进行了基因组测序,以确定绝经前年轻女性患者肿瘤中富集的基因组的驱动因素。
选择了1509个肿瘤样本进行有针对性的DNA测序,另外,还选择了一个较小的年轻年龄病例对照子样本进行全外显子测序(WES)。经过排除后,有1258个样本可用于分析。来自病例对照子样本的82例年轻患者成功完成了WES,其中73例(78%)成功测序了肿瘤/正常对,9例(10%)成功测序了肿瘤样本,但没有正常样本。主要终点为无远处复发间期(DRFI)。
研究结果
1.绝经前HR+/HER2-乳腺癌的基因组景观
图1A为1276例患者体细胞驱动基因组成的基因组景观图。每个肿瘤中识别到的中位驱动基因个数为3。96个肿瘤样本中未发现驱动基因变异(占7.5%)。至少有50例患者(≥4%)携带22个致癌驱动基因,其中9个是突变型(PIK3CA、GATA3、MAP3K1、CDH1、PTEN、KMT2C、TP53、AKT1、CBFB),4个是抑癌基因,包括突变和/或拷贝数(CN)删除(BRCA2、BRCA1、PMS2、RB1),其余的位于常见扩增的染色体区域,如11q13(CCND1、PAK1、EMSY)、8p11(FGFR1)、8q24(MYC)、17q23(PPM1D)、14q21(FOXA1)和21q22(RUNX1)。
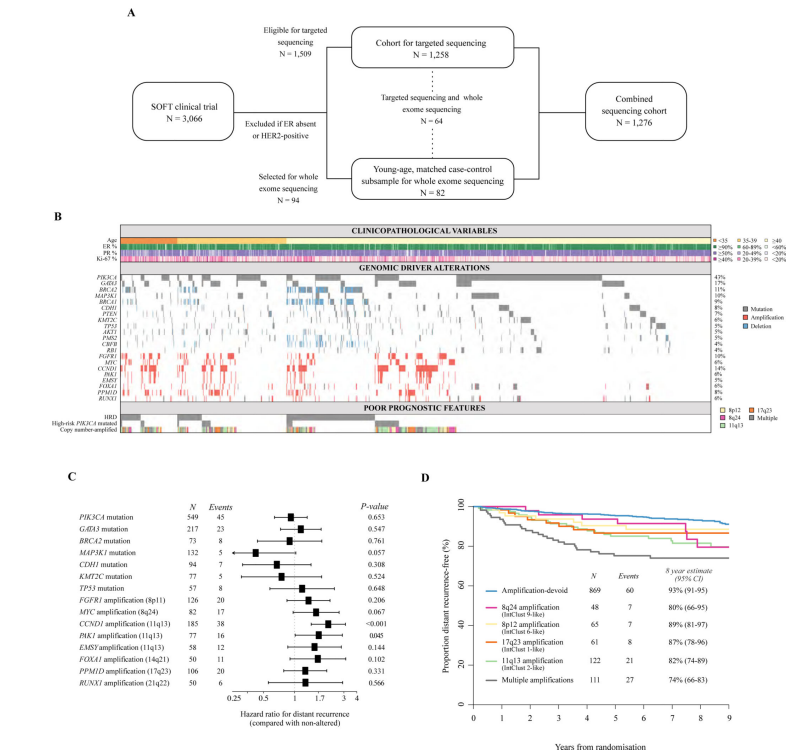
图1. SOFT研究中绝经前HR+/HER2-乳腺癌的基因组特征
ERBB2突变较少见(n=23,占2%),未检测到ESR1突变。BRCA2、BRCA1、MAP3K1和PTEN等常见肿瘤抑制基因中在个体肿瘤样本中观察到了双重或多重基因组改变,但这种情况相对较少。染色体11q13、8q24、14q21、8p11、17q23和21q22上的CNAs与远处复发风险增加相关,类似结果已在BIG 1–98研究的绝经后患者中报告。相比之下,MAP3K1突变与较低的远处复发风险相关,PIK3CA突变与远处复发风险减少相关,但这并不具有统计学意义。与OS的相关性显示出相似的结果。
对早期乳腺癌进行整合分析,确定了10个IntClusts,每个都具有独特的CN和预后特征。这些IntClusts大多数是由特征性的基因水平CN异常所定义。对于HR+HER2-乳腺癌,主要的IntClust亚组是由特征性CNAs定义。与CNA-devoid组相比,类似于整合簇数据,每个CNAs组都与较高的远程复发风险显着相关,唯一的例外是在染色体17q23上有扩增的患者组。与OS的CNA关联也观察到了类似的发现。
本绝经前患者队列中CNA的发生率与参加BIG 1–98临床试验和TCGA-Breast数据库的绝经后妇女中观察到的相似。CNA-devoid组具有最佳预后,8年无远处复发生存率为93%,OS率为95%。值得注意的是,被分类为“多重扩增”的患者预后最差,8年无远处复发生存率为74%,OS率为79%。
2.
与年龄较大的绝经前患者相比,SOFT试验中年龄
与≥40岁的患者相比,
相比于年龄较大的绝经前患者,
图2. 年轻患者预后不佳的基因驱动因素
3.年轻病例对照亚组的WES结果
在年轻病例对照亚组中,CCND1基因扩增与更高的远处复发风险显著相关。虽然没有发现体细胞突变数目与基因组完整性指数(wGII)存在显著相关性,但在存在基因组倍增的肿瘤中观察到显著更高数量的突变(p
在评估的肿瘤中,Signature 1是最常见的突变信号(72%),这种突变是指DNA中5-甲基胞嘧啶的自发脱氨基化,通常与患者年龄的增加有关。但与先前的报道相比,与APOBEC诱变有关的信号相对较少。Signature 3则在既往研究中被认为与DNA修复缺陷相关,存在于22%的肿瘤中。
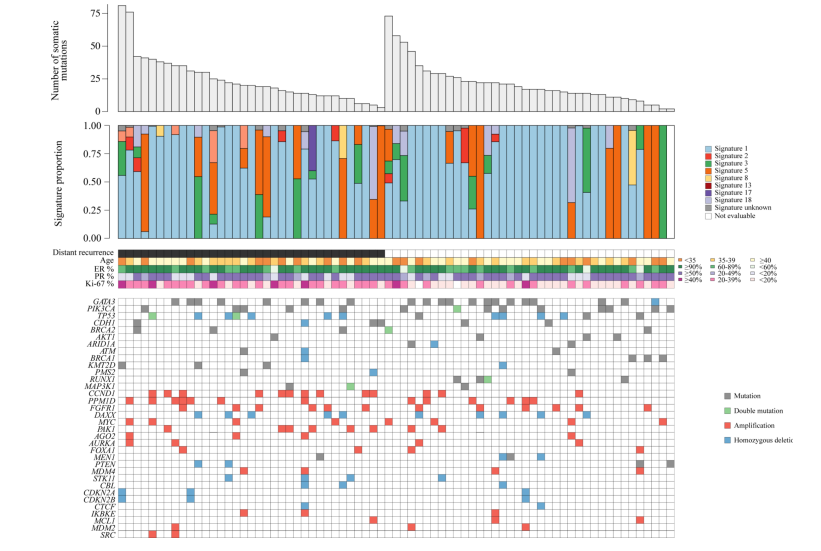
图3. 年轻病例对照亚组的WES结果
4.同源重组缺陷(HRD)的基因组特征
通过eHRDetect算法分析HRD特征,68个可评估的肿瘤中有21个测试呈阳性。在21例eHRDetect-阳性肿瘤患者中,只有4例患有BRCA2基因胚系突变,1例患有BRCA1基因胚系突变(5/21,24%)。未发现PALB2、RAD51C或RAD51D基因的胚系突变(图4A)。SigMA的结果与eHRDetect一致。
eHRDetect-阳性肿瘤的中位Ki-67水平为25%,而eHRDetect-阴性肿瘤中为18%(图4B)。体细胞突变数量(p=0.56)或基质肿瘤浸润淋巴细胞数量(p=0.38)在不同HRDetect状态下没有显著差异(图7B)。与eHRDetect-阴性肿瘤相比,eHRDetect-阳性肿瘤的远处复发率更高(62% vs 40%,OR=6.5,p=0.080)。并且,eHRDetect-阳性肿瘤发生率随着年龄的减小而增加:40岁以下患者中为41%,35岁以下患者中为47%,而40-45岁的患者中为14%(图4B)。
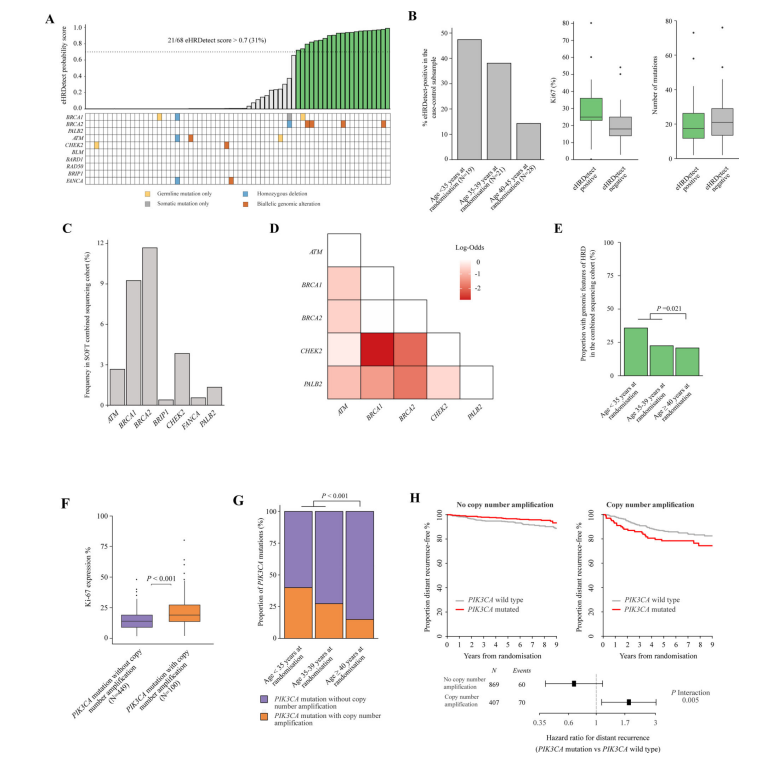
图4. HRD和年轻患者中高风险PIK3CA突变的基因特征
1276例患者有274例(21%)至少有一个HRD相关的基因组改变,其中BRCA2(12%)和BRCA1(9%)变异最为普遍(图4C)。在这274例患者中,68例(24.8%)至少一个HRD相关基因组改变被预测为生殖系基因组改变。这些基因之间显著的两两互斥关系表明功能上存在冗余(图4D)。
综合而言,HRD基因组特征存在于SOFT临床试验的绝经前合并测序队列的288例患者(23%)中,包括具有eHRDetect阳性和/或HRD相关基因遗传变异的肿瘤。在年龄<40岁的患者中,HRD发生率显著高于≥40岁的患者(27% vs 21%,p=0.021,图4E),在随机分组时,<35岁的患者中这一频率进一步增加(n=44,36%)。
5.PIK3CA突变乳腺癌的异质性结局
PIK3CA突变是唯一一种表现出在年龄
6.对绝经前HR+/HER2−乳腺癌的预后进行基因组亚型划分
上述研究结果确定了在这一异质性乳腺癌亚型中与不同预后特征相关的关键基因组特征。这些特征可能有助于定义潜在的治疗靶点,为绝经前乳腺癌进行基因组亚型划分提供了理论基础,从而有利于制定新的治疗策略。
不良预后的基因组特征在年轻患者中富集:在年龄
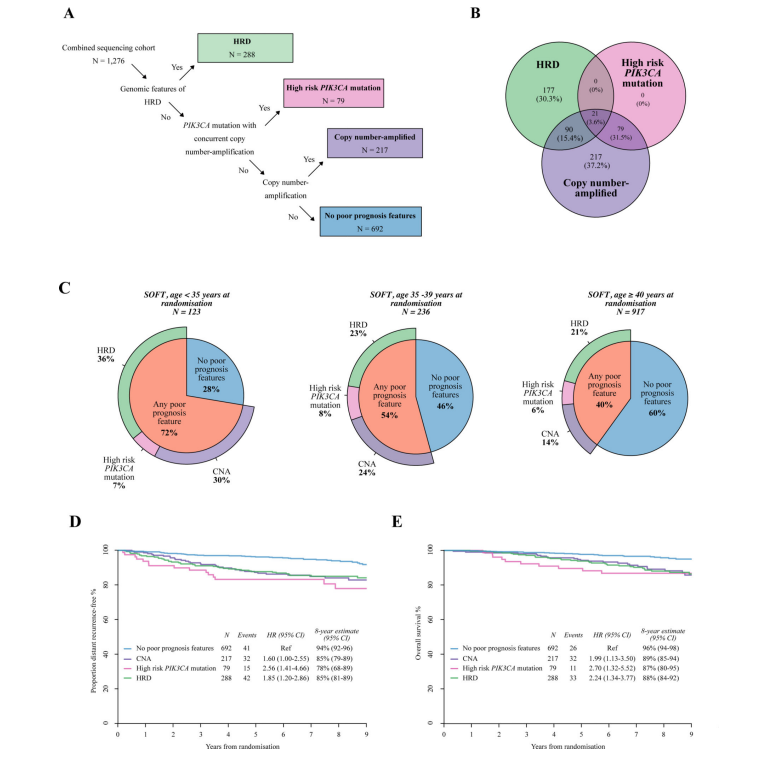
图5. 对于绝经前HRD、HER2-乳腺癌的基因组亚型划分框架
研究结论
本研究探讨了<40岁与≥40岁的HR+/HER2-早期乳腺癌绝经前女性的不同肿瘤基因组特征,发现了年轻女性中HRD、PIK3CA突变伴拷贝数扩增和拷贝数扩增的基因组特征明显富集,而非绝经状态本身影响。后续在HR+/HER2-早期年轻乳腺癌患者开展针对这些特定分子途径的前瞻性试验将对改善其临床结果至关重要。
参考文献:
Luen SJ, Viale G, Nik-Zainal S, et al. Genomic characterisation of hormone receptor-positive breast cancer arising in very young women. Ann Oncol. 2023 Apr;34(4):397-409.
限 时 特 惠: 本站每日持续更新海量各大内部创业教程,一年会员只需98元,全站资源免费下载 点击查看详情
站 长 微 信: lzxmw777




