MST (Microscale Thermophoresis) 微量热泳动技术,是一种定量分析生物分子间相互作用的前沿技术。通过精确检测荧光变化,结合灵敏的热泳动现象,定量分析分子间相互作用。
实验时对互作分子中的一个分子进行荧光标记,使之成为非常灵敏的标签分子,在 MST 技术中称之为 Target;与之互作的另一个分子称之为 Ligand。Target 分子与 Ligand 分子结合形成复合物,复合物分子的尺寸、水化层和电荷的改变都可以导致复合物分子的热泳动速度相对于 Target 分子热泳动速度发生改变,因此很容易检测到到由 Target 与 Ligand 分子的结合引起的 MST 信号变化。
进行 MST 实验时将 Ligand 分子按照2倍的浓度梯度稀释配制16管溶液,然后和 Target 分子等体积混合,吸入毛细管后放入仪器中进行检测。检测时仪器中的红外激光束对毛细管的的检测区域正中心进行加热,激光束周围的溶液形成温度梯度,分子在温度梯度溶液中由高温区域向低温区域定向移动,并且移动速度和分子的尺寸大小、水化层及电荷有关。激发光激发 Target 分子上的荧光基团,通过检测 Target 分子荧光基团发出的发射光的荧光强度变化,从而记录了热泳动速度的差异。然后将荧光强度的数值做纵坐标,配体浓度做横坐标进行拟合作图,软件自动计算得到该结合的亲和常数 KD 值。(图1)
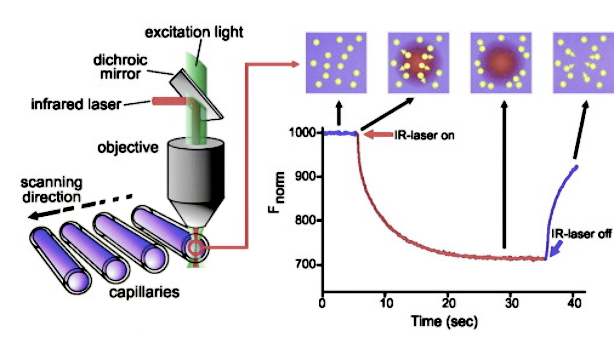
图1 微量热泳动技术 (MST) 工作原理
进行 MST 实验需对重组表达纯化的蛋白进行荧光标记以制备 Target 分子。但是有些蛋白很难进行分离纯化,导致无法进行体外分子互作实验。利用 MST 免纯化技术,对于难以纯化的蛋白可以构建其 GFP 融合蛋白,制备细胞裂解液直接进行 MST 实验。MST 免纯化技术原理如下图所示。
图2 MST免纯化实验示意图
案例一
MST在膀胱癌发生发展
机制研究中的应用
膀胱癌 (BLCA) 是公认的泌尿系统恶性肿瘤之一,2023年,武汉大学王行环教授团队在 Nature Communications 上发表了题为“DNA polymerase POLD1 promotes proliferation and metastasis of bladder cancer by stabilizing MYC”的研究成果[1]。
研究人员发现 POLD1 是膀胱癌恶性转变过程中的一个关键分子,在此基础上,团队证实 POLD1 在膀胱癌组织中较癌旁组织高表达。研究者在体内和体外实验中证明了 POLD1 能够促进膀胱癌的增殖和转移,并在进一步机制研究中发现,POLD1 通过与 FBXW7 竞争性结合 MYC,从而减弱 FBXW7 介导的 MYC 泛素化降解。此外,研究人员还发现 POLD1 与 MYC 形成的复合物参与 MYC 的转录调控,增强 MYC 的转录活性;另一方面,MYC 能够转录激活 POLD1,从而形成了一个 POLD1-MYC 正反馈回路,增强了对膀胱癌的促癌作用[1](图3)。
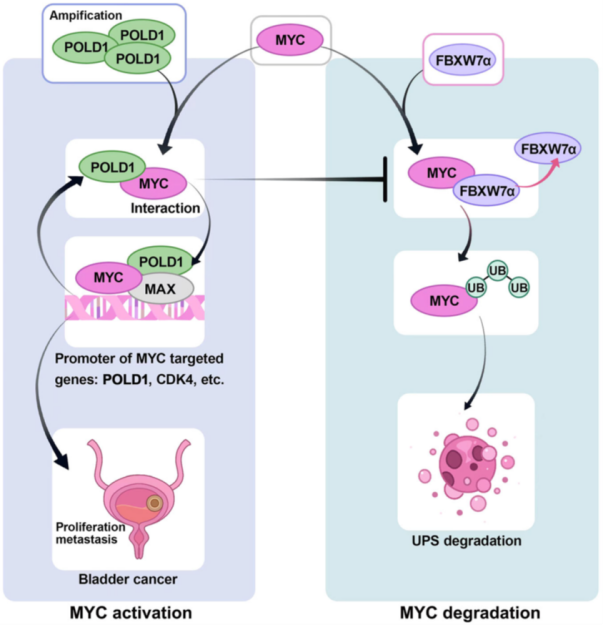
图3 POLD1 通过稳定 MYC 调节 BLCA 的增殖和转移,促进膀胱癌发生发展
研究人员首先通过 CO-IP 验证了 POLD1 与 MYC 的结合,而当去掉 MYC 中与 FBXW7α 结合的区域 MB1 后,就检测不到 POLD1 与 MYC 的结合。为了进一步确定 POLD1 和 MYC 的精确结合区域,研究团队合成了 MB1 肽段,然后使用 MST 技术检测了 GFP-POLD1 与 MB1 肽之间的亲和力,并与 GFP-FBXW7α 作对比,证明 GFP-POLD1 对 MB1 的亲和力比 GFP-FBXW7α 与 MB1 的亲和力高近20倍,因此 POLD1 可以与 FBXW7α 竞争结合 MYC (图4)。在这个实验中,GFP-POLD1 和 GFP-FBXW7α 都是与 GFP 融合过表达在 293T 细胞,直接使用细胞裂解液作为 Target 进行检测,无需纯化蛋白。
图4 MST 检测含 GFP-POLD1、GFP-FBXW7α 的细胞裂解物与 MYC-MB1 (WT) 肽的亲和力
Microscale thermophoresis (MST) assay
MST is a biomolecular interaction analysis technology. It measures the affinity between a ligand and a target molecule by observing the changes in its conformational size, charge, and solvation state after binding to the target molecule66. We overexpressed GFP-POLD1 or GFP-FBXW7αin 293T cells and then lysed the collected cells with IP lysis buffer. The affinity between the whole cell lysate and the MBI peptides (WT: APSEDIWKKFELLPTPPLSP, T58A: APSEDIWKKFELLPAPPLSP, T58D: APSEDIWKKFELLPDPPLSP) was detected by a Monolith NT.115 instrument (NanoTemper). The concentration of MBI peptide was set as follows: 2.5 mM, 0.51× 2.5 mM, 0.52× 2.5 mM, 0.53× 2.5 mM, 0.54× 2.5 mM, 0.55× 2.5 mM, 0.56× 2.5 mM, 0.57× 2.5 mM, 0.58× 2.5 mM, 0.59× 2.5 mM, 0.510× 2.5 mM, 0.511× 2.5 mM, 0.512× 2.5 mM, 0.513× 2.5 mM, 0.514× 2.5 mM and 0.515× 2.5 mM. The data were obtained from three independent repeated experiments, and the results were displayed by GraphPad Prism 7.0.
案例二
MST在细菌c-di-GMP调节硝酸盐
同化分子机制研究中的应用
环二鸟苷酸 (c-di-GMP) 是一种细菌中广泛存在的第二信使,它通过下游受体调节生物被膜形成、运动性和细菌毒力等多种生理功能。2023年,华中农业大学陈雯莉教授课题组在 Nucleic Acids Research 杂志在线发表题为“Cyclic di-GMP inhibits nitrate assimilation by impairing the antitermination function of NasT in Pseudomonas putida”的研究论文。该研究揭示了细菌第二信使 c-di-GMP 通过其受体 NasT 调控恶臭假单胞菌的硝酸盐同化过程的分子机制。
在该研究中,研究者构建了恶臭假单胞菌转录因子蛋白文库并从库中筛选 c-di-GMP 受体。结果发现,转录因子 NasT (PP_2093) 能特异性结合 c-di-GMP,是 c-di-GMP 的新受体。采用 MST 微量热泳动技术进一步验证了上述结论,研究人员通过表达纯化 NasT-GFP 融合蛋白(纯化 GFP 融合蛋白可以避免宿主蛋白对 MST 实验的干扰),再利用 MST 技术测定 NasT-GFP 融合蛋白与 c-di-GMP 的亲和力,结果发现 NasT-GFP 融合蛋白能够与 c-di-GMP 结合,且亲和力值 Kd 为 6.49 ±2.44 μM,而 GFP 蛋白不与 c-di-GMP 结合(图5)。
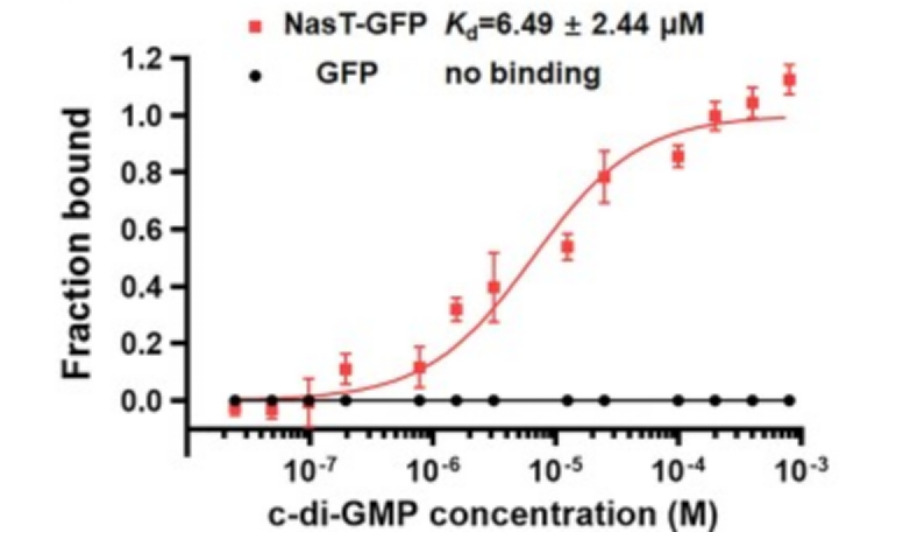
图5 NasT 特异性结合 c-di-GMP
研究者进一步通过生长实验和基因表达检测实验证实了恶臭假单胞菌中 NasT 在 nirBD 操纵子表达中的作用。此外,研究人员采用 MST 实验发现:NasT- GFP 融合蛋白能与 nirBD 操纵子前导 RNA (NalA) 结合,亲和力 Kd 值为0.27 ±0.12 μM, 而 GFP 蛋白不与 NalA 结合,说明 NasT 能与 NalA 结合;但是当体系中分别加入不同浓度的 c-di-GMP 后,随着 c-di-GMP 浓度的升高,造成 NasT 与 NalA 亲和力 Kd 值升高,亲和力减弱。(图6)说明高水平 c-di-GMP 抑制 NasT 与 NalA 的结合,进而抑制 NasT 的抗终止功能,导致 nirBD 转录水平下调。
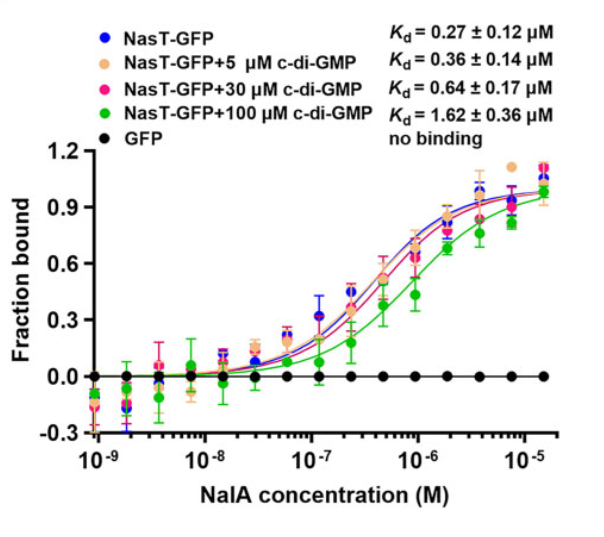
图6 NasT- GFP、c-di-GMP 与 NalA 竞争性结合分析
研究团队在恶臭假单胞菌中发现了一个新的 c-di-GMP 受体 NasT,同时还发现 c-di-GMP 通过减弱 NasT 与亚硝酸盐还原酶前导 RNA 的相互作用抑制亚硝酸盐还原酶的表达,最终抑制细菌的硝酸盐同化,为抗细胞感染药物的研发提供了新靶点。
Microscale thermophoresis (MST) assay
MST was performed to analyze the interaction between NasT and c-di-GMP/NalA。 A green fluorescent protein (GFP) encoding gene was fused to the end of nasT in pET-28a-nasT to achieve fusion expression。 The fusion protein NasT-GFP was induced and purified as described above in protein library construction。 The obtained NasT-GFP was dialyzed with MST buffer (50 mM Tris–HCl [pH 7。8], 150 mM NaCl, 10 mM MgCl2, 0。05% Tween 20)。 Commercially available c-di-GMP (Biolog Company C057, Germany) was resolved with ultrapure water。
GFP protein was used as the negative control。 The MST assay was performed on a Monolith Instrument NT。115 device using standard treated capillaries (NanoTemper Technologies, Germany)。 The concentration of NasT-GFP/GFP was constant at 50 nM, and the concentration of c-di-GMP/NalA was varied from 0。024 to 800 μM (cdi-GMP) or 0。91 to 15 000 nM (NalA) with a 2-fold gradient。 The experiment was recorded using the Nano-BLUE fluorescent detector。 Measurements were performed in MST buffer。
The MO. Affinity Analysis software (version 2.3) was used to calculate the dissociation constant (Kd) from triplicate reads of measurements.
参考文献
[1]Wang, Ye**peng, et al. “DNA polymerase POLD1 promotes proliferation and metastasis of bladder cancer by stabilizing MYC.” Nature Communications 14.1 (2023): 2421.
[2]Nie, Liang, et al. “Cyclic di-GMP inhibits nitrate assimilation by impairing the antitermination function of NasT in Pseudomonas putida.” Nucleic Acids Research 52.1 (2024): 186-203.
[3]Nanotemper 公众号
佰莱博生物利用生物物理检测平台 (MST、SPR 、ITC、BLI)、高内涵细胞成像与分析系统(HCS,High-content screening)、与体外药筛 (AlphaScreen、ADP-Glo、TR-FRET) 等多种检测技术、nanoDSF、MALS(动静态光散射)、AUC (分析型超离)、CD (圆二色光谱技术)、Luminex、CETSA 等检测技术平台交叉验证。提供生物大分子表征、生物分子互作分析、药物筛选、生物大分子稳定性分析及制剂筛选等服务。
目前,佰博莱生物分子互作平台已经具有 T 细胞的主要免疫调节因子 (Gal-1,Gal-3和Gal-9)、与糖尿病相关的胰岛素受体 (IR-A、IR-B、IGF-1R)、GLP-1R、HSA 等重要靶点相关亲和力研究、血管内皮生长因子 (VEGF 121、VEGF165)、免疫球蛋白 Fc 受体 (Fcγ RI、Fcγ RIIB、Fcγ RIIIA、不同种属的FcRn) 相关亲和力研究、免疫球蛋白超家族的细胞黏附分子 (Nectin-1,Nectin-2,Nectin-3,Nectin-4) 及整合素家族 (aVβ5、ITGB1、aVβ3等) 相关亲和力等重要靶点研究亲和力检测服务以及基于 AlphaScreen 技术的 (EED、ERα、Galectin 3等靶点) 高通量化合物筛选服务。
限 时 特 惠: 本站每日持续更新海量各大内部创业教程,一年会员只需98元,全站资源免费下载 点击查看详情
站 长 微 信: lzxmw777






