CD248 induces a maladaptive unfolded proteinresponse in diabetic kidney disease
CD248在糖尿病肾病中诱导不适应的未折叠蛋白反应
Journal:Kidney international
PMID : 36309126
DOI:10.1016/j.kint.2022.09.024
IF :19.6
Keywords: CD248; CHOP; diabetic kidney disease; glomerular damage;mesangial cells; sXBP1
Abstract:
肾小球系膜细胞的功能障碍在糖尿病肾病(Diabetic kidney disease,DKD)的发病机理中起主要作用,糖尿病肾病是肾衰竭的主要原因。然而,潜在的分子机制还不完全清楚。通过对葡萄糖刺激的肾小球系膜细胞进行无偏倚的基因表达分析,我们鉴定出跨膜受体CD248是最上调的基因(gene),而不适应的未折叠蛋白反应(unfolded protein response, UPR)是最受刺激的途径之一(pathway)(注释:内质网(ER)在维持蛋白质和钙稳态方面具有重要的功能。DKD经常与导致UPR激活的ER功能障碍相关,最近的临床前研究表明,不适应的UPR信号在DKD的发病机制中起着关键作用)。CD248的上调在体外葡萄糖刺激的肾小球系膜细胞中得到进一步证实,且在从糖尿病小鼠分离的肾小球中(Ⅰ型和Ⅱ型糖尿病糖尿病),以及来自DKD患者的肾小球肾切片均得到验证。时间过程分析显示,肾小球CD248诱导先于蛋白尿、系膜基质扩张和适应性不良UPR激活(以转录因子C/EBP同源蛋白(CHOP)诱导为标志)的发作,但同时伴随着适应性UPR调节子剪接X盒结合蛋白(XBP1)的丢失。从机制上讲,CD248通过抑制体内和体外肌醇需求酶1a ( inositolrequiring enzyme 1a,IRE1a)介导的转录因子XBP1剪接来促进适应性不良UPR信号传导。
(注释:毒素介导的内质网蛋白折叠损伤同时激活内质网膜驻留蛋白启动的3条主要途径:肌醇需求酶1 (IRE1a)、双链RNA激活蛋白激酶(PKR)样内质网激酶(PERK)和激活转录因子6(at F6)。然后文献查阅发现:在感应到未折叠蛋白后,内质网跨膜传感器IRE1a寡聚化、自身磷酸化,并利用其核糖核酸内切酶活性从转录因子XBP1的mRNA中切除内含子,产生剪接的XBP1(sXBP1)。sXBP1易位到细胞核中,并与内质网相关降解和内质网伴侣基因的调控区中的靶序列结合。)CD248诱导包含热休克蛋白90、BH3相互作用结构域死亡激动剂(BID)和IRE1a的多蛋白复合物,其中BID阻碍IRE1a介导的XBP1剪接并诱导CHOP介导的适应性不良UPR信号传导。虽然CD248基因敲除改善了DKD相关的肾小球功能障碍并逆转了适应性不良的未折叠蛋白反应信号,但伴随的XBP1缺陷消除了糖尿病CD248基因敲除小鼠的保护作用,支持了CD248和XBP1在体内的功能性相互作用。因此,在DKD,CD248是一种新的诱导不适应UPR信号的肾小球系膜细胞受体。(注释:出生后,CD248 mRNA在大多数器官中的表达减少,但在肾脏中持续存在。特别是在肾小球系膜细胞和血管周细胞中。CD248敲除小鼠在单侧输尿管梗阻和单侧缺血-再灌注损伤模型中免受肾纤维化的影响。单细胞转录组分析表明,CD248在人类DKD的肾小球系膜细胞中上调,但在其他肾细胞中不上调。CD 248是否诱导DKD的肾脏变化,以及这是否与DKD的不适应UPR有关,仍不清楚。)
RESULTS:
1.CD248 expression and maladaptive UPR signaling are upregulated in glucose-stressed mesangial cells
在葡萄糖刺激下的系膜细胞中,CD248表达上调和不适应UPR信号上调
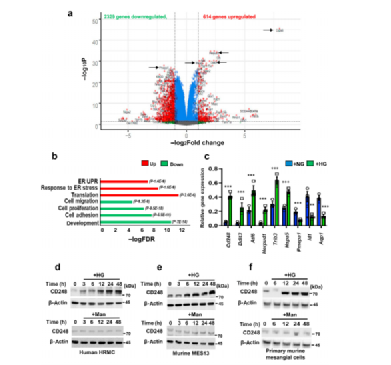
Fig1a: 通过RNA测序对在正常或高糖条件下的小鼠系膜细胞系(MES13)进行了转录组测序分析:共有2943个基因在高糖条件下差异表达,其中614个基因上调,2329个基因下调;差异基因表达分析发现,Ⅰ型跨膜受体CD248是高糖刺激下肾小球系膜细胞中表达最高的基因;
Fig2b: 基于基因本体论的上调基因的分子通路富集分析表明,蛋白质翻译(P值为3.6E-6)、内质网应激应答(P值为1.6E-6)和UPR(P值为1.4E-6)是最高上调的通路;(补充:一些编码内质网应激应答、UPR、内质网相关降解或内质网伴侣蛋白的基因,如Ddit3、XBP1、ATF6、Herpud1、Trib3、Dnajb9和Hspa5,被发现是最上调的靶点(补充表S1)。)
Fig2c: 从表达分析中挑选出的结果通过qRT-PCR反应分析进行验证,证实了CD248、Ddit3、ATF6、Herpud1、Trib3和Hspa5的表达上调,以及Pmepa1、Id1和AQP1的表达下调;
Fig1d-f: 为了验证高糖条件是否诱导系膜细胞中CD248的蛋白水平的表达,我们使用了人肾系膜细胞、小鼠系膜细胞和分离的原代小鼠系膜细胞:在高糖环境下(以甘露醇为渗透压作对照),CD248在这些细胞中的表达呈时间依赖性增加。
补充: 为了测试CD248的上调是否具有细胞类型特异性,分析了正常(5 mM)或高糖(25 mM)葡萄糖或甘露醇(25 mM)刺激的人肾小球系膜细胞、人肾内皮细胞和人足细胞中CD248转录本的表达:高糖诱导的CD248表达上调仅限于系膜细胞;与小鼠肾小球内皮细胞、小鼠足细胞和小鼠近端肾小管细胞相比,在小鼠肾小球系膜细胞中也获得了类似的结果。
数据表明,葡萄糖依赖的CD248表达上调仅限于肾小球系膜细胞。这些结果表明,CD248和UPR信号相关基因的表达在体外葡萄糖刺激的肾小球系膜细胞中受到协同调控。
2.CD248 expression is increased in DKD
CD248在DKD中的表达增加
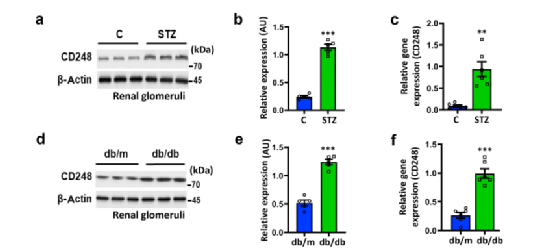
Fig2a-f: 考虑到CD248在系膜细胞中的表达,接下来研究了CD248在链脲佐菌素(STZ)诱导的糖尿病小鼠和db/db小鼠(分别为Ⅰ型和Ⅱ型糖尿病模型)肾小球中的表达:与非糖尿病对照组小鼠相比,两种糖尿病模型组小鼠肾小球CD248的mRNA和蛋白表达水平均增加;
Fig2g-i: CD248与系膜细胞标记物α-平滑肌肌动蛋白(αSMA)和血小板衍生生长因子受体β(TGF-β-补充图里)共染色,证实两种糖尿病小鼠系膜细胞CD248表达上调;
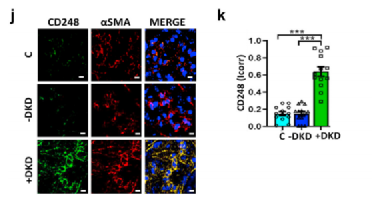
Fig2j-k: 为了评估这一发现与人类DKD的相关性,分析了来自健康对照组和有无DKD的糖尿病患者的人肾样本。基于共染色分析,与糖尿病无DKD患者和健康对照组相比,有DKD的糖尿病患者系膜细胞CD248的表达显著被诱导。

3.Glomerular CD248 induction precedes experimental DKD-associated early glomerular defects
肾小球CD248的诱导先于实验性DKD相关的早期肾小球缺陷
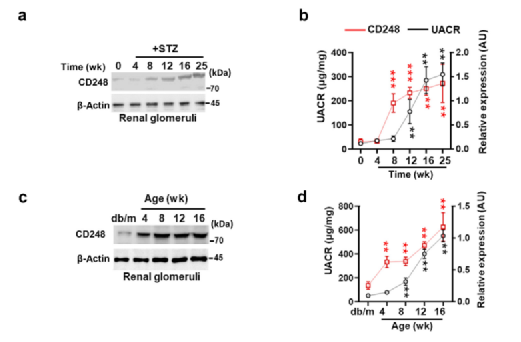
Fig3a-h: 时间过程分析显示肾小球增加 CD248的表达先于蛋白尿和系膜基质扩张的发生在两种糖尿病模型的小鼠中(stz和db/db);Ⅰ型糖尿病和Ⅱ型糖尿病小鼠的肾小球CD248的表达上调分别在后8周和4周龄时发生,但在给药后12周,在Ⅰ型糖尿病模型中可以检测到蛋白尿,在Ⅱ型糖尿病模型中,在8周龄时可以检测到蛋白尿;类似地,由系膜面积分数确定的系膜基质扩张量的增加跟随着肾小球CD248的升高,这表明CD248的诱导先于DKD相关的肾小球功能障碍。

4.Loss of CD248 protects against DKD
CD248的缺失可以保护防止DKD
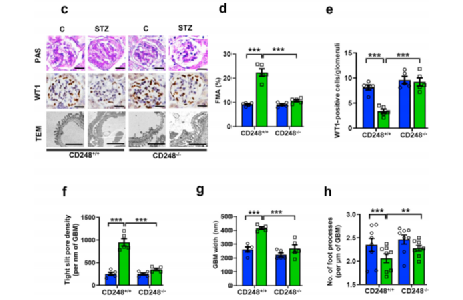
Fig4a-b:为了评估CD248在DKD中的功能相关性,我们用STZ诱导了野生型(CD248+/+)和CD248全局基因敲除(CD248-/-)小鼠的持续性高血糖,尽管野生型和CD248-/-小鼠之间的血糖水平相似(补充图S3A),但在服用STZ的 10、16和25周后,糖尿病CD248-/-小鼠的蛋白尿显著低于糖尿病野生型小鼠, 同样,糖尿病CD248-/-小鼠的血尿素氮和血肌酐水平较低。
Fig4c-h:此外,糖尿病CD248-/-小鼠肾小球系膜面积分数增加、足细胞丢失、肾小球基底膜宽度增加、足细胞足突数量减少和紧密缝隙孔密度增加等与DKD相关的肾小球损害明显减轻。
虽然我们只观察到CD248对蛋白尿和肾小球滤过减少的部分保护作用,但CD248-/-小鼠的形态指标与非糖尿病对照组小鼠没有区别。这些结果表明CD248通过一种未明确的机制促进DKD肾小球功能障碍。

(补充) :鉴于CD248在肾小球系膜细胞中的表达,以及高糖诱导系膜细胞外基质基因表达和促纤维化转化生长因子β1信号转导,我们分析了CD248缺陷的系膜细胞和对照系膜细胞中相应的结果发现:检测了ECM相关基因fibronectin
(Fn), collagen 1a2 (Col 1a2), Laminin, and Tgfb1, TGFb1-secretion, and phosphorylation of SMAD2 (pSMAD2),高糖容易诱导CD248+/+小鼠的原代系膜细胞ECM基因和Tgfb1的表达、TGFβ1的分泌以及pSMAD2的水平,而从CD248-/-小鼠分离的系膜细胞不能诱导ECM基因和TGFβ1的表达、TGFβ1的分泌和pSMAD2的水平;CD248对照(Scr)和CD248基因敲除(ShCD248)系膜细胞(补充图S4G-K)也观察到了相应的变化。这些结果反映了糖刺激肾小球系膜细胞的典型表型变化,这些细胞是以CD248依赖的方式调节的。
5.CD248 inhibits XBP1 splicing and promotes maladaptive UPR signaling
CD248抑制XBP1剪接,促进非适应性UPR信号转导
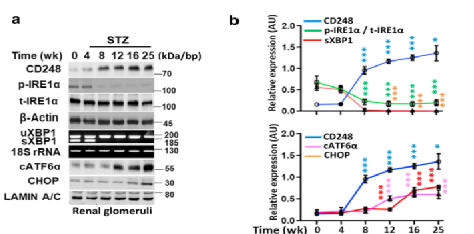
CD248在基因表达分析中是最上调的基因,内质网应激反应相关的通路是葡萄糖刺激肾小球系膜细胞表现为最上调的通路。这一发现提出了CD248是否与ER信号有关的问题。STZ诱导和db/db糖尿病小鼠肾小球CD248的表达确实与IRE1a磷酸化丧失、XBP1剪接减少以及切割后的ATF6和CHOP的核水平的增加有关(补充结果)。
Fig5a-d: 时间过程分析显示,在糖尿病小鼠肾小球中,CD248的诱导暂时伴随着磷酸化IRE1a (p-IRE1a)和sXBP1水平的降低;此外,在两种小鼠糖尿病模型中,肾小球CD248的诱导和IRE1a介导的XBP1剪接减少之后,切割的ATF6和CHOP的核水平增加。
Fig5e: 重要的是,在糖尿病CD248-/-小鼠中,既没有观察到肾小球p-IRE1a和sXBP1水平的降低,也没有观察到ATF6和CHOP切割的诱导,表明DKD相关的适应不良UPR依赖于CD248的诱导。
Fig5f: 与这一发现一致的是,DKD相关的UPR和ER应激相关基因在糖尿病CD248-/-小鼠中缺失。

补充材料:为了确定CD248对系膜细胞UPR信号转导的细胞特异性作用,我们在体外通过shRNA介导的敲除抑制了CD248在小鼠系膜细胞MES13中的表达。
高糖刺激转SCR基因的系膜对照细胞后,p-IRE1a和sXBP1水平降低,裂解ATF6和CHOP核水平升高,而CD248基因敲除导致p-IRE1a和sXBP1持续水平和裂解ATF6和CHOP水平降低,反映了不适应UPR信号对CD248抑制的改善(补充图S6A)。
在转录分析中发现上调的UPR靶基因的转录水平在CD248缺失的系膜细胞中也同样降低,这意味着CD248调控系膜细胞中的UPR基因。
为了评估CD248是否通过抑制IRE1a/sXBP1信号通路来调节不适应的ATF6和CHOP介导的UPR,我们在体外将shCD248和SCR系膜细胞暴露于IRE1a RNase结构域抑制剂4u8C。IRE1a RNase结构域的抑制减弱了CD248在高糖条件下对sXBP1、ATF6、CHOP、UPR和ER应激相关基因的影响。这些结果表明,在体内和体外,CD248通过抑制IRE1a介导的XBP1剪接而促进不适应性UPR信号转导。
6.Interaction between CD248, HSP90, and IRE1a induces maladaptive UPR signaling
CD248、HSP90和IRE1a相互作用诱导不适应性UPR信号转导
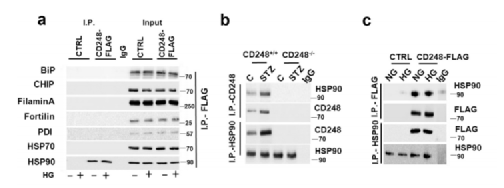
为了研究CD248是如何与IRE1a联系的,我们分析了 CD248与已知的IRE1a调控因子的相互作用,已知IRE1a的活性受UPRosome、动态多蛋白复合体的调节,其中IRE1a与调节蛋白相互作用,如HSP90、Bax抑制物-1(BI-1)、Fortilin、丝蛋白A、氧化还原酶-蛋白质二硫键异构酶(PDI)和Hsc70蛋白的羧基末端相互作用蛋白。为了确定CD248抑制IRE1a介导的XBP1剪接的相关蛋白,从转导CD248的肾小球系膜细胞中免疫共沉淀。
Fig6a: CD248与HSP90相互作用,而其他被测试的蛋白在系膜细胞中不与CD248相互作用;
Fig6b-c:CD248与HSP90的相互作用在糖尿病小鼠体外肾小球样本(图6b)以及CD248FLAG转基因和非转基因对照系膜细胞(图6c)中得到验证;
Fig6d: 共转染实验证实,在CD248-FLAG转染组和未转染组对照肾小球系膜细胞中,FLAG标记的CD248与HSP90相互作用;
Fig6e: 接下来分析了CD248的过度表达或高糖暴露(诱导CD248的表达)是否影响了IRE1a与上述调节因子之间的相互作用。与以前的报道一致,所有研究的蛋白质都与IRE1a相互作用;然而,与其他调节因子不同的是,在葡萄糖应激或CD248过表达的细胞中,只有IRE1a-HSP90的相互作用增加。
Fig6f-g: 免疫共沉淀法证实,IRE1a-HSP90在体内糖尿病小鼠的肾小球样本中以及在葡萄糖刺激或体外高表达CD248的肾小球系膜细胞中相互作用。值得注意的是,在糖尿病和非糖尿病CD248-/-小鼠中,IRE1a-HSP90相互作用减少,证实CD248是IRE1a-HSP90相互作用所必需的。
Fig6h: 在高糖暴露或CD248过表达的情况下HSP90被敲除的系膜细胞,依赖CD248的适应性不良UPR信号转导(以ATF6a和CHOP诱导为特征)减弱,确定依赖CD248的不适应UPR信号需要HSP90。


7.CD248-dependent inhibition of IRE1a is mediated by BID
依赖CD248的IRE1a抑制是由Bid介导的
已知HSP90主要增强蛋白质的结构完整性,因此不太可能直接抑制IRE1a介导的XBP1剪接。因此,我们研究了是否有其他蛋白质参与了由CD248、HSP90和IRE1a组成的复合体,并传递了对IRE1a-XBP1信号的抑制作用。Bid可直接结合并抑制IRE1a。
Fig7a-b: IRE1a和BID之间的相互作用在葡萄糖刺激和CD248高表达的肾小球系膜细胞和CD248+/+糖尿病肾小球中增加,但在非糖尿病或糖尿病CD248-/-小鼠的肾小球中高度减弱,表明BID与IRE1a之间的相互作用是CD248依赖的。
Fig7c: 在HSP90被敲除后,在葡萄糖刺激和CD248高表达的系膜细胞中,Bid和IRE1a之间的相互作用减少,这表明HSP90是形成由HSP90、Bid和IRE1a组成的多蛋白复合体所必需的。
Fig7d-e: 为了验证BID对IRE1a磷酸化和剪接活性的抑制作用,我们在对照和CD248敲低的系膜细胞中过表达了BID-HA标记的结构。BID过表达降低了pIRE1a和sXBP1的水平,增加了ATF6a和CHOP的蛋白水平,以及不适应UPR基因的转录水平,与在葡萄糖刺激的对照细胞中观察到的水平相当。
综上所述,我们的结果支持了一个模型,在该模型中,高糖诱导的CD248表达促进了系膜细胞中由HSP90、BID和IRE1a组成的多蛋白复合体的形成,其中IRE1a的磷酸化、剪接活性和sXBP1介导的细胞保护反应被BID抑制。



8.XBP1 deficiency prevents the protective phenotype in CD248-deficient diabetic mice
XBP1缺陷阻止CD248缺陷糖尿病小鼠的保护性表型
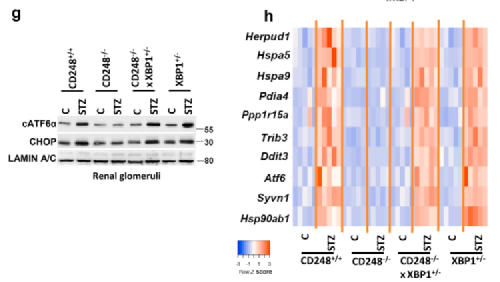
这些数据表明,CD248缺乏对DKD小鼠肾脏的保护作用依赖于持续的IRE1a-XBP1介导的适应性UPR信号。为了研究XBP1的功能相关性,我们在小鼠中从基因上降低了XBP1的表达。考虑到缺乏具有系膜细胞特异性Cre表达的小鼠系,以及纯合子XBP1缺陷对小鼠胚胎的致死性,我们通过产生CD248-/-x XBP1 Tail/-小鼠来部分降低XBP1的表达。
补充:糖尿病小鼠出现稳定的高血糖,与糖尿病野生型、CD248-/-和XBP1-/-小鼠相似。然而,在糖尿病CD248-/-小鼠中观察到的保护作用在CD248-/-x XBP1-/-小鼠中降低。
Fig8a-b: 此外,与糖尿病CD248-/-鼠相比,CD248-/-x XBP1-/-鼠的蛋白尿和血尿素氮水平升高。
Fig8c-f: 肾小球损害的形态指标也观察到类似的结果,如系膜面积分数增加,每个肾小球的足细胞数量减少,肾小球基底膜宽度增加,紧密缝隙孔密度增加,足突数量减少。
Fig8g-h: 伴随着XBP1信号的降低,糖尿病CD248-/-x XBP1 Towa/-小鼠中切割的ATF6和CHOP的核水平以及不适应UPR基因的转录水平增加,支持XBP1在改善CD248-/-小鼠的DKD中的关键作用。
补充:为了进一步探讨CD248缺乏是否通过XBP1调节系膜细胞表型变化,我们分析了正常或高糖暴露的CD248、CD248-/-、CD248-/-x XBP1/-和XBP1/-小鼠系膜细胞中ECM基因(FN、Col1a2、laminin和TGFβ1)的转录水平和分泌TGFb1的水平:尽管高糖暴露的CD248-/-细胞没有纤维化改变,但高糖处理的CD248-/-x XBP1/-或XBP1/-系膜细胞ECM基因的表达和分泌的TGFβ1水平增加。这些结果证实了CD248诱导的葡萄糖依赖的纤维化改变是通过XBP1介导的。

Conclusion:
我们发现I型跨膜受体CD248是系膜细胞非适应性未折叠蛋白反应(UPR)的诱导物。糖尿病肾病(DKD)相关的CD248诱导抑制细胞保护性IRE1a介导的XBP1剪接,而CD248基因敲除可改善DKD相关的肾小球功能障碍,逆转不适应性UPR信号。CD248在DKD中的表达增强,再加上CD248缺陷小鼠缺乏有害的表型,表明CD248是一个有吸引力的治疗靶点。针对CD248(ontuxizumab,scFv-78Fc)的抗体治疗方法已经开发出来,已经在癌症患者中进行了评估,并且耐受性良好。对DKD患者来说,改变这些抗体的用途可能是一个有吸引力的治疗选择。

限 时 特 惠: 本站每日持续更新海量各大内部创业教程,一年会员只需98元,全站资源免费下载 点击查看详情
站 长 微 信: lzxmw777






